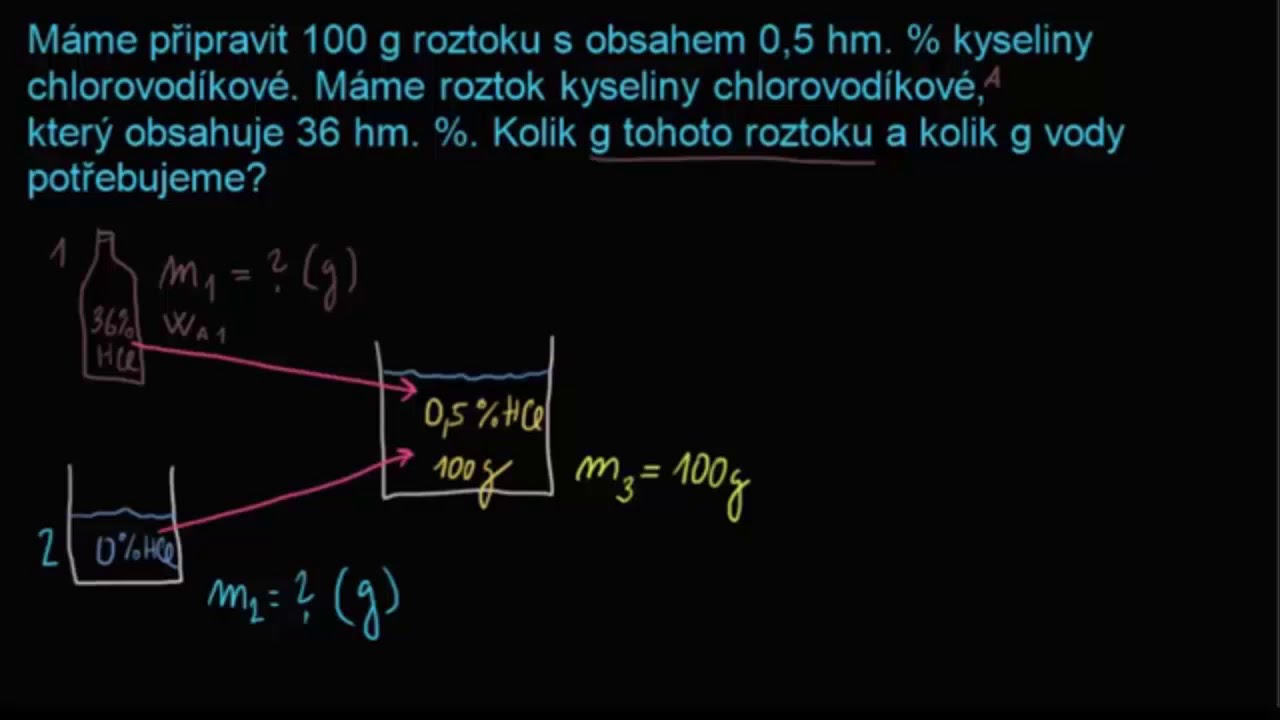
Jak počítat ředění
Vzorce pro výpočet těchto veličin jsou vždy stejné: V = V1 + V2, c = (c1*V1 + c2*V2) / V. V je zde objem a c koncentrace roztoku, veličiny s indexem se vztahují k 1., resp. 2. roztoku.
Archiv
Jak vypočítat roztok
Veličina se zpravidla označuje malým písmenem c a z definice ji počítáme podílem látkového množství rozpouštěné látky (n) a objemu roztoku, ve kterém je rozpuštěna (V): c = n/V.
Archiv
Jak namíchat 10% roztok soli
Příklad: Příprava 10 % (v/v) etanolu. 10 ml etanolu je doplněno vodou do 100 ml. Hmotnostně-objemová procenta (w/v %) jsou definovaná počtem gramů látky na 100 ml výsledného roztoku.
Archiv
Jak vypočítat 5% roztok
1) Procentní koncentrace
Ukazuje, kolik dílů rozpuštěné látky se nachází v 100 dílech roztoku. Příklad 1. 5 % roztok NaCl znamená, že v 100 dílech (g, kg, t, …,) roztoku je 5 dílů NaCl a 95 dílů vody.
Jak pripravit 1% roztok
Příklad: Máme připravit 1 % (w/v) NaCl. Použijeme tedy 1 g NaCl, který rozpustíme v daném roztokku (případně ve vodě) a doplníme do výsledného objemu 100 ml. Výpočet molární koncentrace z procentuální koncentrace: Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě.
Jak se počítá pH
Pro silné zásady platí, že molární koncentrace iontů OH-I a molární koncentrace zásady si jsou rovny. Při výpočtu pak dosazujeme do vztahu pro výpočet pOH za koncentraci iontů OH-I přímo koncentraci zásady. pH pak vypočítáme ze vztahu pH=14 – pOH.
Co je 10% roztok
Zober 10 gramov látky, rozpusti to v 50 – 75 ml vody a po rozpustení dolej na 100 ml. nene, je to deset gramů látky a devadesát gramů (=ml) vody, aby to celkem dalo 100 gramů, tudíž bude mít ve výsledném roztoku ta látka desetiprocentní podíl.
Jak vypočítat 10% roztok
Rozpuštěním 20 g cukru ve 180 g vody vznikne 10% roztok.
Co znamená 2M roztok
Molární koncentrace (molarita)
Molarita roztoku se někdy zkráceně označuje písmenem M. Např. 2M znamená, že roztok je dvoumolární, tedy s koncentrací 2 mol/dm3.
Jak zjistit pH roztoku
Pro měření pH se používají indikátorové papírky. Jsou napuštěny různými chemickými látkami, tzv. indikátory, které při změně pH mění barvu v důsledku probíhajících chemických reakcí. Další metoda – měření pH-metry, je založena na elektrochemickém principu.
Co je to pKa
Disociační konstanta kyseliny KA je číselným vyjádřením protolytické rovnováhy, která nastane při disociaci kyseliny v roztoku. V praxi se obvykle konstanta acidity vyjadřuje ve formě záporného dekadického logaritmu disociační konstanty kyseliny při teplotě 25°C jako pKA.
Jak počítat procenta roztoku
počet hmotnostních dílů rozpuštěné látky na 100 hmotnostních dílů roztoku krát 100. podíl objemu rozpuštěné látky a objemu celého roztoku krát 100. Objemová procenta roztoku závisí na teplotě. Příklad: 300 cm3 roztoku obsahuje 164 cm3 100% alkoholu.
Jak vypočítat faktor zředění
Například: v případě, že pipetujeme 25 ml z odměrné baňky 250 ml titrujeme vlastně pouze jednu desetinu vzorku. Z toho vyplývá, že vý- sledek musíme násobit 10krát. Toto číslo nazýváme faktor zředění F, nebo také zředění Z.
Co je to pH v chemii
pH (anglicky potential of hydrogen, latinsky pondus hydrogenii, či potentia hydrogenii, tj. „potenciál vodíku“), též vodíkový exponent je číslo, kterým se v chemii vyjadřuje, zda vodný roztok reaguje kysele či naopak zásaditě (alkalicky).
Jak z pH Vypocitat koncentraci
Známe-li pH nebo pOH roztoku můžeme k výpočtu koncentrace oxoniových kationtů resp. hydroxidových aniontů použít inverzní funkci k funkci logaritmické. Je to funkce 10x .
Jak vypočítat pKa
pKa je definováno jako záporný logaritmus Ka. Pokud bychom chtěli pKa pro methanol, tak zlogaritmujeme Ka a vezmeme zápornou hodnotu. pKa je tedy záporný logaritmus. 2,9 x 10 na mínus šestnáctou.
Jak pripravit 20% roztok
Příklad: Máme připravit 20 % (w/w) NaCl. Použijeme tedy 20 g NaCl, které rozpustíme ve 100 g výsledného roztoku (případně ve vodě). Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku.
Jak vypočítat faktor
Faktor odměrného roztoku se vypočítá podle vztahu: f = s1/s2 , kde s1 je teoretická spotřeba odměrného roztoku, s2 je skutečná spotřeba odměrného roztoku. Teoretická spotřeba se vypočte z chemické rovnice nebo se určí z hmotnosti standardu, která odpovídá 1 cm3 odměrného roztoku o přesné molární koncentraci.
Jak vypočítat pH roztoku
pH roztoku vypočteme jako její záporný dekadický logaritmus. NaOH je silná jednosytná zásada, která je ve zředěném roztoku zcela disociovaná. Koncentrace OH- iontů bude proto rovna koncentraci kyseliny. pH roztoku vypočteme jako její záporný dekadický logaritmus.
Co je to pka
Disociační konstanta kyseliny KA je číselným vyjádřením protolytické rovnováhy, která nastane při disociaci kyseliny v roztoku. V praxi se obvykle konstanta acidity vyjadřuje ve formě záporného dekadického logaritmu disociační konstanty kyseliny při teplotě 25°C jako pKA.
Jak připravit roztok
Každý roztok se skládá z rozpouštědla a rozpuštěné látky a představuje stejnorodou, tedy homogenní směs. V anorganické chemii bývá rozpouštědlem hlavně voda. Nejčastěji se setkáváme s roztoky pevné látky a kapaliny nebo roztoky dvou kapalin.
Co je to Volumetrie
Titrace (volumetrie, odměrná analýza) je běžná laboratorní metoda kvantitativní chemické analýzy. Je to metoda, pomocí které se stanovuje neznámé množství látky v roztoku.
Co je to základní látka
Základní látka (primární standard)
Je látka definovaného chemického složení, chemicky čistá (čistota se během skladování nesmí měnit – např. nesmí reagovat s CO2, podléhat oxidaci vzdušným kyslíkem….)
Jak zjistit faktor titrace
Výpočet obsahu stanovované látky ve vzorku
Z té vypočítáme faktor titrace Ft. Faktor titrace je dán poměrem koeficientů stanovované složky a odměrného činidla. Ft = k (s.s.) : k (o. č.)
Jak se titruje
Princip titrace se zakládá na stanovení neznámé koncentrace známého objemu analyzovaného roztoku, do kterého se přidává činidlo o známé koncentraci – nazývané titrační standard nebo zkráceně titr. Ve chvíli, kdy přidáme takové množství činidla, že látky spolu právě a beze zbytku zareagují, nastane bod ekvivalence.